『化学④』有機反応 ー縮合反応① 河東丈二
- nakata513
- 2022年11月2日
- 読了時間: 6分
更新日:2022年11月29日

今回は、高校化学でも登場する有機反応であるエステル合成反応を中心に、その反応が起こるメカニズムを解説します。その細かい分析を通じて、なぜエステル合成に酸触媒が必要であるか、加えてエステル化は可逆反応であるかを読み解きます。最後に、アスピリンの合成反応や身の回りのエステルの合成も、この種の縮合反応の応用例として、記述できることをお話しします。
今回は、高校化学で登場する反応を、大学学部レベルの視点から解説する暴挙に出ます。主な読者にはゴムや樹脂関連の従事者を想定していますが、化学を学んだことがない方も背伸びして読んでほしいという思いを持って書いたので、もしわかりにくい部分があれば遠慮なくコメントをください。
An Overview of Organic Reactions - Condensation Reaction Joji Kawahigashi
This time, I will explain the reaction mechanism, focusing on the ester synthesis reaction, which is an organic reaction that appears in high school chemistry. Through detailed analysis, we will decipher why an acid catalyst is necessary for ester synthesis and whether esterification is a reversible reaction. Finally, I will mention that the synthesis reaction of aspirin and the synthesis of familiar esters can also be described as an application example of this kind of condensation reaction.
This time, I will go out of my way to explain the reactions that appear in high school chemistry from the perspective of a university undergraduate. I assume that the main readers will be those who work in the fields of rubber and resins, but I wrote this with the hope that even those who have never studied chemistry will stretch out and read it. Feel free to comment.
エステル合成反応の 2 つの疑問
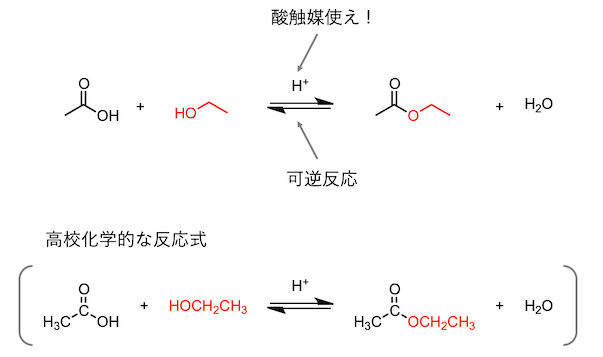
さっそくですが、これを出発点として、酸触媒条件の酢酸とエタノールの反応による酢酸エチルの合成反応を取り上げます。
「なんだ、上のジグザグの構造式は?」と思った読者のために、高校化学的な構造式を下に書きました。ジグザグの構造は、線構造式と呼ばれます。線構造式について、要点だけを解説すると、線が折れている部分に炭素原子があり、水素原子は省略しています。以降は線構造式のみでお話しします。めんどくさいからではなく、情報が適切に省かれており、見やすいからです。
If you're wondering, "What's the zigzag structure above?" The zigzag structure is called a linear structure. Regarding the linear structural formula, if you explain only the main points, there are carbon atoms in the part where the line is broken, and hydrogen atoms are omitted. From now on, I will only talk about line structures. Not because it's cumbersome, but because the information is properly omitted and easy to read.
反応の形式に注目すると、出発物のカルボン酸中の OH 基が エタノール由来の CH3CH2O 基 (赤で書いた部分) で置き換わっています。そして、副生成物として水が生じています。次に、反応式のうち、出発物や生成物以外の部分を見てみます。出発物と生成物は可逆反応の矢印でつながれています。加えて、その矢印の上に H+ と書いてあります。つまり、「酸触媒を使え」と言われています。座学の知識としては「酸触媒はどこに効くのか」あるいは「なぜ可逆反応なのか」という点を暗記しようとすることは煩わしいです。しかし、実際に実験するとなると、この事実をなんとかするための工夫が必要であり、無視できません。
というわけで、これら 2 つの疑問について理解できるように、分子の気持ちになってこの反応機構を一段階ずつ見て行こうと思います。(反応機構ってなんだ? という方はこちらの記事へ。反応機構について一言で説明すると、「ある反応がどのようにして起こっているかを電子の動きで表現したもの」です。)
Two Questions in Ester Synthesis
Without further ado, let us take this as a starting point for the synthesis of ethyl acetate by the reaction of acetic acid and ethanol under acid-catalyzed conditions.
Focusing on the form of the reaction, the OH group in the starting carboxylic acid is replaced by a CH3CH2O group from ethanol (marked in red). And water is produced as a by-product. Next, let's look at the parts other than the starting material and the product in the reaction formula. The starting material and product are connected by a reversible reaction arrow. In addition, it says H+ above the arrow. In other words, it is said that "use an acid catalyst". In terms of classroom knowledge, it is troublesome to try to memorize points such as "where does the acid catalyst work?" or "why is it a reversible reaction?" However, when it comes to actual experiments, it is necessary to devise ways to deal with this fact, and it cannot be ignored.
So, in order to help him understand these two questions, let's put ourselves in the mind of a molecule and go through this reaction mechanism step by step. (If you are wondering what the reaction mechanism is, please refer to this article. To explain the reaction mechanism in a nutshell, it is "the movement of electrons that expresses how a certain reaction occurs.")
第一段階: プロトン化された酢酸が、アルコールを引き寄せる

はじめにカルボニル基の酸素が、非共有電子対をプロトン H+ に差し出して結合を作ります。続いて、この正電荷を帯びたカルボニル基がエタノール中の酸素の非共有電子対を引き寄せます。このとき、エタノールの酸素原子が、カルボニル炭素を叩いて、C=O 二重結合の π 電子をカルボニル酸素へ移動させます。
「酸触媒はどこに効くのか」に対する答え 1
このまま、話を進めてもいいのですが、少し立ち止まって、先ほど挙げた質問の一つ目である、「酸触媒はどこに効くのか」という問題に答えます。上の説明を読むと、どうやら「エタノールが酢酸に攻撃する前に、酢酸のカルボニル基がプロトン化されている必要がある」ということがわかります。ここで誤解してはいけないことは、カルボニル基は後々にエステル化される運命を見据えて、よっこらせと足を動かし、プロトンを受け取りに行っているわけではないということです。つまり、プロトン授受のような反応は、酸性溶液中で素早い平衡状態にあります。したがって、「第一段階としてカルボニル基がプロトン化される」と考えるよりも、「プロトン化されていない酢酸分子も反応溶液中にあるけれど、プロトン化されて正電荷を帯びたカルボニル基に、エタノールが引き寄せられる」と考える方が妥当かと思います。
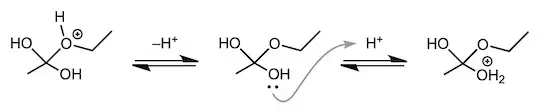
では、「なぜ正電荷を直接帯びているカルボニル酸素に、エタノールが攻撃しないのか」とツッコみたくなった人は、原子の電気陰性度を思い出さなければなりません。つまり、酸素原子と炭素原子では、酸素原子の方が電気陰性度が大きいので、π 電子を酸素原子側へ移動させるために、エタノールがカルボニル炭素を攻撃するのです。
エステル化の反応機構の続きに戻ります。
第2段階と第3段階は次回に続けて書きます。
First step: protonated acetic acid attracts alcohol
First, the oxygen of the carbonyl group donates a lone pair of electrons to the proton H+ to create a bond. This positively charged carbonyl group subsequently attracts the lone electron pair of the oxygen in ethanol. At this time, the oxygen atom of ethanol hits the carbonyl carbon, transferring the π electron of the C=O double bond to the carbonyl oxygen.
Answer 1 to "Where does the acid catalyst work?"
I could go on and on about this, but let's stop for a moment and answer the first question I raised earlier, "Where does the acid catalyst work?" From the explanation above, it seems that the carbonyl group of acetic acid must be protonated before ethanol can attack acetic acid. What should not be misunderstood here is that the carbonyl group does not move its legs to receive protons in anticipation of the fate of being esterified later. That is, reactions such as proton transfer are in rapid equilibrium in acidic solutions. Therefore, rather than thinking that ``the carbonyl group is protonated as a first step'', ``although there are also unprotonated acetic acid molecules in the reaction solution, the protonated and positively charged carbonyl group is attached to the ethanol I think it would be more appropriate to think that
So, if you're wondering why ethanol doesn't attack the carbonyl oxygen, which has a direct positive charge, you have to remember the electronegativity of the atom. In other words, between the oxygen atom and the carbon atom, the oxygen atom has a higher electronegativity, so ethanol attacks the carbonyl carbon in order to transfer the π electrons to the oxygen atom side.
Let's return to the continuation of the esterification reaction mechanism.
I will write the 2nd and 3rd steps next time.



Comentarios